DOI:10.18273/revion.v29n2-2016001
Articulo
Impacto de la
fermentación y secado sobre el contenido de polifenoles y capacidad
antioxidante del clon de cacao CCN-51
Impact of fermentation
and drying in polyphenol content and antioxidant capacity of cocoa variety
CCN-51
Impacto da fermentação e
secagem no teor de polifenóis e capacidade antioxidante do clone de cacau
CCN-51
Andrea Pallares Pallares1;
Mauren R. Estupiñán A1;
Janeth Aidé Perea Villamil2;
Luis Javier López Giraldo1*
1Escuela de Ingeniería Química.
2Escuela de Química. Universidad Industrial de Santander. Grupo en
Ciencia y Tecnología de Alimentos—CICTA. Ciudad Universitaria, Calle 9 Carrera
27. Bucaramanga, Colombia.
*ljlopez@uis.edu.co
Resumen
La influencia del tiempo de fermentación y secado
fue evaluada simultáneamente sobre la capacidad antioxidante (CA) y el contenido de polifenoles totales (PT) de cacao clon CCN-51 (origen ecuatoriano
resultante del cruce ICS95xIMC67), buscando seleccionar condiciones de
beneficio que permitan obtener un producto de mayor valor agregado desde el
punto de vista funcional. Los polifenoles presentes fueron cuantificados usando
el método de Folin–Ciocalteu (PT) y tentativamente identificados por LC-MS, mientras que la capacidad
antioxidante fue analizada usando el método ORAC. El beneficio comprendió las
etapas de microfermentación en cajón y secado natural
al sol. Los análisis siguieron un diseño experimental factorial multinivel de
15 experimentos/muestreo. Las diferencias significativas entre niveles fueron
establecidas con un análisis de varianza. La CA (expresados en micromoles equivalentes de trolox (TE)/gramos de muestra
seca) y el contenido de PT (expresados en miligramos equivalentes de ácido gálico (EAG)/gramo de
muestra seca) variaron significativamente durante la fermentación, registrando
valores entre 1055,2–347,3µmolTE/gMS y 78,1–33,3mgEAG/gMS, respectivamente.
Según el ANOVA, el efecto del secado natural fue poco significativo en la
evolución de dichas variables (p<0,05). La evolución del contenido de PT y
la CA, como una
función de los días de fermentación, se ajustó a un modelo matemático recíproco
(R2>0,95 en ambos casos). Las ecuaciones ajustadas fueron usadas
para predecir la evolución del contenido de PT de clones tipo Forastero y Amazónico, cuando se comparó con resultados
experimentales de otros trabajos, el error relativo porcentual promedio fue de
20%. Finalmente, se estableció que la fermentación ocasiona una disminución en
los monómeros y oligómeros presentes (excepto catequina y procianidina B1) que
puede relacionarse con la disminución de la CA. La fermentación es la etapa del beneficio que mayor impacto genera en
la variación del contenido de PT y la CA.
Palabras clave: cacao, beneficio, CCN-51, polifenoles totales,
capacidad antioxidante.
Abstract
The influence of fermentation and drying time
was evaluated simultaneously on the antioxidant capacity (CA) and total polyphenol content (PT) clone CCN-51, seeking conditions to benefit
leading to a higher value-added product from the point functionally. ORAC (CA) and Folin-Ciocalteu (PT) methods were employed. Polyphenols were tentatively identified by
LC-MS. The profit was realized in stages microfermentation drawer and natural
drying in the sun. The analysis followed a multi-factorial experimental design
of 15 experiments/sampling. Significant differences between levels were
established with an analysis of variance. The CA (expressed in micromole equivalents of trolox (TE)/grams of dried
sample) and PT content (expressed in gallic acid equivalent (GAE)/grams of dried
sample) varied significantly during fermentation, recording values between
1055.2-347.3μmolTE/g (d.b.) and 78.1-33.3mgGAE/g (d.b.), respectively.
According to ANOVA, the natural drying effect was not significant in the evolution
of these variables (p<0.05). The evolution of the content of PT and CA, as a function of days of fermentation, a reciprocal mathematical model
was adjusted (R2>0.95 in both cases). The fit equations were used
to predict of behavior of PT in Forastero and Amazonico clones, when results were compared with
experimental results of other works an average relative error of 20%, was
obtained. Finally, it was established that the fermentation causes a decrease
in the monomers and oligomers present (except catechin and procyanidin B1) that
may be related to decrease CA. Fermentation is the stage of profit generated greater impact on the
variation of the content of PT and CA.
Keywords: cocoa, post-harvest process, CCN-51, total
polyphenols, antioxidant capacity.
Resumo
A influência do tempo de fermentação e secagem
foi avaliado simultaneamente sobre a capacidade antioxidante (CA) e o conteúdo total de polifenóis (PT) clone CCN-51, que pretende seleccionar
condições beneficio que conduzem a um produto de maior valor acrescentado a
partir do ponto funcionalmente. ORAC (CA) e Folin-Ciocalteu (PT) métodos foram empregados. Os polifenóis foram tentativamente
identificados por LC-MS. O lucro realizado em etapas microfermentación gaveta e
secagem natural ao sol. A análise seguiu um delineamento experimental
multi-fatorial de 15 experimentos/amostragem. Diferenças significativas entre
os níveis foram estabelecidos com uma análise de variância. AC (expressos em
micromoles de Trolox/gMS de amostra seca) e conteúdo PT (expresso em miligramas equivalentes de gálico
/ grama de ácido amostra seca) variaram significativamente durante a
fermentação, registrando valores entre 1055,2-347,3μmolTE/gMS e
78,1-33,3mgEAG/gMS, respectivamente. De acordo com a ANOVA, o efeito de secagem
natural não foi significativa na evolução destas variáveis (p<0,05). A
evolução do conteúdo de PT e de CA, como uma função dos dias de fermentação, foi ajustado um modelo
matemático recíproco (R2>0,95 em ambos os casos). As equações
ajustadas foram utilizados para prever a evolução do teor de PT e os clones de
tipo Amazon Forasteiros, quando comparados com os resultados de outros estudos
experimentais, a percentagem média de erro relativo foi de 20%. Finalmente, foi
estabelecido que a fermentação provoca uma diminuição nos monômeros e
oligômeros presentes (exceto catequina e procyanidin B1) que podem estar
relacionados à diminuição da CA. A fermentação é o estágio de lucro maior impacto gerado sobre a
variação do teor de PT e CA.
.
Palabras-chave: cacau, lucro, CCN-51,
polifenóis totais, capacidade antioxidante.
Fecha Recepción: 18 de
febrero de 2016
Fecha Aceptación: 27 de
octubre de 2016
Introducción
En las últimas tres décadas los trabajos de
investigación relacionados con la determinación de las propiedades funcionales
del cacao se han incrementado de forma apreciable [1-4]. Esto, porque se ha
reconocido que dicho material vegetal puede considerarse como un alimento
funcional gracias a que es una fuente natural de antioxidantes, específicamente
polifenoles [5,6].
Los granos de cacao y los productos elaborados a
partir de éstos contienen cantidades importantes de flavanoles, cuyo espectro
se extiende desde simples monómeros hasta formas oligoméricas
y poliméricas llamadas procianidinas. Entre los monómeros sobresalen
cuantitativamente los flavan–3–oles epicatequina y catequina; mientras las
procianidinas B1 y B2 son los oligómeros más abundantes [3].
Las propiedades antioxidantes del cacao son
afectadas por factores como el genotipo, las condiciones agroclimáticas, el
proceso de beneficio (fermentación y secado) y el proceso de industrialización
[1,7]. Durante el beneficio y la subsecuente etapa de tostado se registra una
pérdida sustancial de los componentes polifenólicos presentes en el grano, disminuyendo
por ende la capacidad antioxidante del mismo [1,8,9].
Entre los 22 clones de cacao recomendados por la
Federación Nacional de Cacaoteros de Colombia para ser sembrados en las 4 zonas
agroecológicas del país, se encuentra el CCN-51.
Esta variedad es preferida por un gran número de
cultivadores debido a su alto rendimiento y tolerancia a las enfermedades [10].
Sin embargo, su utilización como materia prima en la elaboración de
chocolatería fina ha recibido críticas de parte de algunos sectores, dadas sus
pobres características de sabor y aroma (bajas tonalidades de sabor a fruta y
rasgos florales, sumadas a un excesivo amargor y alta astringencia). Por tal
razón, entender la evolución del contenido de polifenoles totales (PT) y la capacidad antioxidante (CA) del clon de cacao CCN-51 durante las etapas de
fermentación y de secado, es el punto de partida para la elaboración de
productos enriquecidos con polifenoles usando este clon y se constituye en el
propósito de este trabajo. Se espera de este modo darle mayor valor agregado a
un material que está siendo ampliamente cultivado en el país. A la fecha no se
ha realizado ningún trabajo de investigación con este objetivo.
Materiales y
métodos
Reactivos, solventes y estándares
La solución buffer de fosfato (pH 7,2), Trolox®,
fluoresceína sódica y 2,2′-azobis (2-amidinopropano) dihidrocloruro (AAPH) se
adquirieron de Sigma-Aldrich. El reactivo de Folin-Ciocalteu, carbonato de
sodio, etanol, n-hexano, ácido gálico, ácido fórmico y acetonitrilo fueron comprados
a Merck (Bogotá, Colombia). Todos los reactivos fueron de grado analítico.
Beneficio de los granos de cacao
La recolección y tratamiento de las muestras del
clon de cacao CCN-51 (Origen ecuatoriano resultante del cruce ICS95xIMC67)
fueron realizadas en la granja experimental Villa Mónica de la Federación Nacional
de Cacaoteros de Colombia ubicada en San Vicente de Chucurí, Santander
(693msnm, Tmedia≈27°C). Se hicieron dos muestreos en la época de
cosecha comprendida entre octubre de 2012 y enero de 2013.
Se empleó el método de microfermentación en
cajones propuesto por el Departamento de Investigación de FEDECACAO [11]. El
tiempo de desgrane no superó las 24h y los granos de CCN-51 obtenidos (2,5kg)
fueron ubicados en mallas plásticas de 25×50cm. Inicialmente, las muestras se
dejaron escurrir por 16-18h. Luego fueron presecadas al sol por 30h
(temperatura promedio del tratamiento 27°C a una humedad relativa promedio del
70%). Este pretratamiento permite eliminar el exceso de mucílago que
típicamente tiene el clon CCN-51, el cual conduce a una fermentación que
produce granos de cacao sin descriptores sensoriales especiales [12-14].
Seguidamente, las muestras se introducen en un
cajón de masa total fermentable mayor de 200kg. La primera remoción del grano
se hizo tras 48h y siguieron remociones cada 24h hasta finalizar el proceso (6
días en el cajón). El momento en que comenzó el escurrimiento se consideró el
punto inicial de la fermentación (F0). Con el fin de inactivar la enzima
polifenol oxidasa y evitar el avance de la fermentación y la oxidación, las
muestras del nivel F0 fueron sumergidas en agua a 10-15°C durante 15min.
Posteriormente, se separó el mucílago del grano de cacao y este último fue
introducido en agua a 95°C durante 5min [15]. Se realizó un análisis
cualitativo frente a una muestra sin tratar (blanco) empleando una solución de
1,1g/L de catecol en ausencia de luz. Después de 5min se verificó el grado de
pardeamiento alcanzado por cada uno de los ensayos.
El secado se hizo en una casa elba con techo
móvil, siguiendo el protocolo del Departamento de Investigación de FEDECACAO
[11]; la humedad alcanzada después en cada uno de los niveles de secado (Tabla
1), se determinó empleando el método AOAC 931.04 18th. Los
resultados del porcentaje de humedad fueron usados con el fin de expresar el
contenido de polifenoles totales en base seca. Cada muestra recolectada fue
etiquetada de acuerdo al diseño experimental (Tabla 1) y se mantuvo en
condiciones de refrigeración (4°C), ausencia de luz y oxígeno reducido (empaque
al vacío) hasta la realización de los análisis que se describen a continuación.
Análisis
del contenido de Polifenoles Totales (PT) y Capacidad Antioxidante (CA).
Preparación
de las muestras. Comprendió las etapas de desengrasado y
extracción de polifenoles, según lo propuesto por Cadena y Herrera [16]. Un
gramo (1g) de muestra (descascarillada y molida) fue desengrasado con 10mL de
n-hexano en un baño ultrasónico (LC 30H, Elma Ultrasonics,
Singen, Alemania) por 15min a 30°C. Seguidamente, se centrifugó (equipo Heraeus
Megafuge 16R, Thermo Fisher Scientific, Waltham, Massachusetts, USA) a 3500rpm
durante 15min a 25°C.
Este proceso se realizó tres veces. Para la
extracción de polifenoles, la muestra desengrasada fue puesta en contacto con
20mL de una solución etanol:agua (80:20v) a 60°C y
agitación constante durante 15min. Luego, fue centrifugada (utilizando los
mismos parámetros empleados en el desengrasado) y el sobrenadante se pasó a
través de papel filtro (papel cualitativo, con una retención de 10µm, Filter
Paper, Munktell, Bärenstein, Germany).
La extracción fue realizada tres veces y
finalmente las fracciones filtradas fueron concentradas mediante evaporación a
50°C y 100mbar (rotoevaporador R-210, Büchi, Valinhos, Brasil). Cada extracto
fue aforado a un volumen de 25mL con una solución etanol:agua
(50:50v) y almacenado a 4°C hasta su uso. Fueron preparados dos extractos por
muestra recolectada. Algunos de ellos (uno por nivel de fermentación) fueron
seleccionados y liofilizados para su posterior análisis por cromatografía
líquida. El proceso de liofilización se realizó empleando un liofilizador SP
Scientific, AdVantage Plus Freeze Dryers, modelo Wizard 2,0. Inicialmente, se
desarrolló un secado primario a 233,15K y 0,013MPa durante 36h, seguido de un y
secado secundario en gradiente desde 263,15 hasta 318,15K durante 24h.
Ensayo
de Folin-Ciocalteu (FC). El
contenido de Polifenoles Totales (PT) de las muestras se determinó siguiendo el
procedimiento descrito por Wollgast [17]. El ensayo fue hecho por duplicado a
cada extracto. Brevemente, 50µL del extracto a valorar, 1,5mL de reactivo de
Folin-Ciocalteu (diluido 10 veces en agua destilada) y 1,5mL de solución de Na2CO3
(7,5% p/v) fueron mezclados vigorosamente. La mezcla fue dejada en reposo
durante 60min protegida de la luz. Luego, la absorbancia de las muestras fue
leída a 765nm en un espectrofotómetro (GENESYS 20, Thermo Spectronic, Waltham,
Massachusetts, USA). El contenido de PT se expresó en mg equivalentes de ácido gálico (mgEAG) por gramo de
muestra seca (gMS). Para la cuantificación del contenido de PT se construyó una curva patrón (relación lineal
entre la absorbancia y la concentración de la sustancia de referencia) en la
que se empleó como sustancia de referencia el ácido gálico (AG). El procedimiento
experimental empleado es idéntico al descrito anteriormente. La única
diferencia es que en lugar de extracto a valorar se emplea la sustancia de
referencia. Finalmente, el contenido de PT fue calculado empleando la Ecuación 1 y expresado en mg equivalentes de
ácido gálico
(mgEAG) por gramo de muestra seca (gMS).
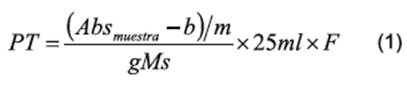
En donde: Absmuestra representa la absorbancia de la muestra, gMs representa el peso de la muestra (gramos), m (1,748) representa la pendiente y b
(0,018) el intercepto de la curva patrón,
V es el volumen de aforo y F factor de dilución de la muestra analizada.
Ensayo ORAC (Oxygen Radical Absorbance Capacity). La medición de la capacidad antioxidante
(CA) se desarrolló de acuerdo al método planteado por Huang et al. [18]. En los pozos de una
microplaca oscura de 96 lugares se adicionaron los reactivos, en el orden que
se especifica a continuación: 150µL de solución de fluoresceína [8,16x10-5mM],
25µL de Trolox® [6,25–50µM], extracto [0,0468–0,1238mgEAG/gMS] o buffer de
fosfato (según fuera a ubicarse en el pozo el estándar, la muestra o el blanco
del ensayo, respectivamente) y 25µL de solución de AAPH [153mM]. Antes de
añadir el AAPH, la microplaca con la fluoresceína y el antioxidante fue
precalentada a 37°C durante 10min.
Inmediatamente después de la adición del
iniciador de radicales, se midió en un espectrofluorímetro (Fluoroskan Ascent,
Thermo Scientific, Waltham, Massachusetts, USA) la señal de fluorescencia cada
minuto durante 1h. Las longitudes de onda de excitación y emisión fueron 485 y
530nm, respectivamente. Cada concentración evaluada se analizó por triplicado
(4 concentraciones por extracto). Los resultados se expresaron en µmol
trolox-equivalente por gramo muestra seca (µmolTE/gMS).
Análisis de cromatografía líquida acoplada a masas (LC-MS-ESI-IT). La
separación e identificación de los
polifenoles presentes se hizo acorde al procedimiento desarrollado por Cienfuegos-Jovellanos
et al. [19]. A partir de las muestras
liofilizadas se prepararon soluciones de concentración 1mg/mL, que fueron
pasadas a través de un filtro PTFE de 0,45µm. Se realizó
inyección directa (volumen de inyección: 20µL) a un equipo de cromatografía
líquida con detector UV-Vis (Elite LaChrom, VWR-HITACHI), adaptado a un
espectrómetro de masas (Amazon X, Bruker Daltonis, Ponte Alta – Atibaia,
Brasil) con nebulización por electrospray (ESI) y analizador de trampa iónica
(IT). Para la separación se utilizó una columna de fase reversa Zorbax Eclipse XDB-C18
(150×4,6mm, 5µm), a 25°C. La fase móvil consistió en agua:ácido
fórmico (99,9:0,1v) (solvente A) y acetonitrilo (solvente B), a una velocidad
de flujo de 0,8mL/min. El gradiente fue el siguiente: 0-20min, 6-10% B lineal;
20-25min, 10-13% B lineal ; 25-30min, 13-15% B lineal; 30-40min, 15-10% B
lineal; 40-45min, 10-6% B lineal, seguido de 10min de re-equilibrio de la
columna antes de una nueva inyección. El detector del espectrómetro de masas se
operó en modo full scan negativo; la inyección a la fuente
de iones del electrospray se efectuó
con un splitting del 40%.
En la trampa de iones, la temperatura y el
voltaje del capilar fueron 355°C y -6V. El voltaje del spray fue de 4,7kV. Los
cromatogramas se registraron a 280nm. La identificación de las sustancias
presentes se hizo tomando como base los espectros de masas (iones
pseudomoleculares de los compuestos de interés) y el orden de elución en el
perfil cromatográfico y comparación con estándares.
Análisis estadístico
La influencia de los tiempos de fermentación y
secado sobre el contenido de PT y la CA fue estudiada empleando el diseño experimental factorial multinivel que
se muestra en la Tabla 1.
El análisis estadístico se desarrolló empleando
el software STATGRAPHICS Centurion XVI (Trial
version ).
Las diferencias significativas entre los valores
promedio obtenidos fueron determinadas mediante la prueba Tukey HSD. A través
de un análisis de varianza se establecieron los factores con efecto
significativo sobre las dos variables de respuesta.
Tabla 1.
Factores y niveles del diseño experimental.

Resultados
Contenido de Polifenoles Totales (PT)
En la Figura 1 se muestra el efecto de los días
de fermentación y secado sobre el contenido de PT del clon de cacao CCN-51. La gráfica obtenida
puede ser dividida en tres regiones con
tendencias bien definidas en lo que se refiere a la evolución de los PT durante el proceso de beneficio del clon
analizado: inicial (F0 y F2), intermedia (F4) y final (F6 y F8), con valores
promedio de 73,48±4,93, 47,85±6,46 y 36,68±2,08mgEAG/gMS, respectivamente.
De acuerdo con el análisis de varianza, los días
de fermentación tienen un efecto significativo sobre el contenido de PT del clon CCN-51 con un nivel de confianza del
95%.

Figura 1. Variación del contenido de polifenoles totales durante la fermentación (F) y el secado (S) del clon de cacao
CCN-51. Los resultados se expresan como la media ± desviación estándar para
n=8. S1, S3 y S5 representan 1, 3 y 5 días de secado, respectivamente. Las
letras (a,b,c,d,e) expresan diferencias significativas
entre medias con un nivel de confianza p<0,05.
El diagrama de Pareto de la Figura 2 esquematiza
los resultados del ANOVA, evidenciando la incidencia negativa de esta etapa del
beneficio en la variable de respuesta analizada. El secado, por su parte, no
posee efecto significativo en el contenido de PT.

Figura
2. Diagrama de Pareto estandarizado de la influencia de la fermentación y del
secado sobre el contenido de polifenoles totales del clon de cacao CCN-51.
Una vez establecido que los días de fermentación
son la variable relevante durante el proceso de beneficio del clon CCN-51, la
evolución del contenido de PT pudo ajustarse a un modelo matemático para predecir el comportamiento
observado.
El ajuste tomó en cuenta los datos
experimentales a partir del segundo día de fermentación, dado que aquellols
obtenidos para las muestras sin fermentar estuvieron muy por debajo de lo
esperado y/o reportado en la bibliografía relacionada. Se propuso un modelo
unifactor del tipo recíproco (Ecuación 2) para explicar la variación del
contenido de PT en función del tiempo de fermentación (TF).

El coeficiente de correlación ajustado (R2),
considerando el conjunto de datos experimentales sobre los cuales se hizo el
ajuste (2≤TF≤8), fue de
0,963. En la Figura 3 puede apreciarse el grado de coincidencia presentado
entre el modelo propuesto y los datos experimentales.

Figura 3. Grado de ajuste a los datos experimentales del modelo propuesto para predecir la evolución del contenido de
polifenoles totales en función del tiempo de fermentación.
Capacidad antioxidante (CA)
En el caso de la CA se determinó que, de forma similar a como ocurre con el contenido de PT, la fermentación es el factor que genera mayor
incidencia. En general, a medida que avanza la fermentación del clon CCN-51, la
CA disminuye.
Los valores obtenidos se presentan en la Figura 4, expresados en µmolTE/gMS.
Al igual que como en el caso de los polifenoles
totales, la variación de CA puede dividirse en tres etapas en función del proceso de beneficio:
inicial (F0 y F2), intermedia (F4) y final (F6 y F8), con valores ORAC promedio
de 969,42±68,44, 593,24±110,06 y 404,20±53,00μmolTE/gMS, respectivamente. En el
diagrama de Pareto presentado en la Figura 5 se observa que la fermentación y
el secado tienen incidencia significativa sobre la variable de respuesta con un
nivel de confianza de 95%. El proceso fermentativo posee un efecto negativo
sobre el valor de CA, mientras que el efecto del secado no es significativo a excepción de
F4 (entre S1 y S3-S5).
Aunque según el ANOVA ambas etapas del beneficio
del clon CCN-51 afectan de forma significativa el valor de la CA, pudo inferirse que el secado tiene un impacto
mínimo sobre la variable de respuesta. Esto, luego de comparar la relación F (σintergrupos/σintragrupos) de este factor (F=8,12) respecto
a la de la fermentación (F=257,79).

Figura
4. Variación de la capacidad antioxidante durante la fermentación (F) y el
secado (S) del clon de cacao CCN-51. Los resultados se expresan como la media ±
desviación estándar para n=8. Las letras (a,b,c,d,e)
expresan diferencias significativas entre medias con un nivel de confianza
p<0,05.

Figura 5. Diagrama de Pareto estandarizado de la influencia de la fermentación y del secado sobre la capacidad antioxidante
del clon de cacao CCN-51.
El resultado obtenido permitió verificar que
existe una correlación inversa entre la CA y el grado de fermentación del clon CCN-51. Por el contrario, la
variación en los días de secado dio lugar a valores de CA que oscilaron en un intervalo de valores
prácticamente constante, es decir, se confirmó la existencia de una correlación
nula entre la CA del clon CCN-51 y este factor. Nuevamente se ajustó un modelo
matemático unifactor recíproco para relacionar la CA del clon CCN-51 con la variable del beneficio que tiene la mayor
incidencia sobre su variación: la fermentación (Ecuación 3). Los datos
experimentales considerados para tal ajuste, en congruencia con lo expresado en
el ítem de polifenoles totales, fueron aquellos recolectados del día 2 al 8 de
fermentación.

El coeficiente de correlación ajustado (R2),
calculado en el intervalo 2≤TF≤8, fue de 0,959. En la Figura 6 puede apreciarse el grado de ajuste del
modelo propuesto, al igual que los datos experimentales.

Figura
6. Grado de ajuste a los datos experimentales del
modelo propuesto para predecir el comportamiento de la capacidad antioxidante en función del tiempo de fermentación del
clon de cacao CCN-51.
Cuando se evalúa el tipo de relación existente
entre el contenido de PT y de la CA, el resultado es una correlación lineal directa, con un grado de ajuste
(R2) de 0,95 (Figura 7). Esta tendencia no sólo es propia del cacao,
ella ha sido observada en otro tipo de matrices [1, 20-22].

Figura
7. Relación entre la cantidad de polifenoles
totales y la capacidad antioxidante
en el clon de cacao CCN-51.
Separación e identificación de sustancias polifenólicas
Para la realización de esta prueba fueron
seleccionadas cuatro muestras del diseño experimental: todas al mismo nivel de
secado (5 días), del día 2 a 8 de fermentación. En la Figura 8 se muestra el
perfil cromatográfico obtenido para una muestra con 2 días de fermentación y 5
días de secado. En cada uno de los extractos analizados fueron obtenidas 11
señales bien definidas análogas a los mostrados en la Figura 8. La
identificación tentativa de las sustancias se hizo comparando el espectro de
masas (m/z del ion pseudomolecular de
carga simple o múltiple) con lo reportado en la literatura en estudios
similares [22-25]. Además, se tuvo en cuenta el orden de elución de cada
compuesto en el perfil cromatográfico. Los resultados del análisis por
espectroscopía de masas se muestran en la Tabla 2.
Tabla 2.
Compuestos fenólicos tentativamente identifi
cados por LC-MS en el clon de cacao CCN-51.


Figura 8. Perfil cromatográfico (HPLC) de la muestra F2S5. Ver Tabla 2 para la identificación de las señales.
Luego de identificar las sustancias
antioxidantes presentes en los extractos, se evaluó cualitativamente su variación
durante el proceso fermentativo. Se tomó como referencia el nivel 2 y a partir
de éste se calcularon valores relativos en los demás niveles. La Figura 9
muestra el comportamiento seguido por los monómeros (catequina y epicatequina),
dímeros y oligómeros (trímeros a heptámeros) hallados en las muestras. Todos
los flavonoides identificados, a excepción de la procianidina B1 y la
catequina, siguieron una tendencia de reducción en los niveles evaluados;
dentro de cada nivel de fermentación la cantidad relativa de procianidina B2,
epicatequina y sus oligómeros permaneció aproximadamente constante (Figura 9). constante (Figura 9). Los mayores valores relativos se
presentaron en el segundo día de fermentación y fueron disminuyendo
progresivamente con el avance del proceso hasta el día seis. La reducción del
día 2 al 4 fue del 35%, con un valor relativo de 0,65±0,03. Por su parte, la
relación F6/F2 se ubicó alrededor de 0,40±0,03; la disminución fue del 60%. La
muestra correspondiente al nivel F8 mostró valores de área inferiores a la
muestra F2 en un 65%; en este caso el valor relativo se fijó en 0,34±0,05.
Entre el sexto y el octavo día de fermentación el porcentaje de desviación
relativa fue inferior a 15%. Salvo por la muestra correspondiente al cuarto día
de fermentación, la catequina y la procianidina B1 presentaron valores
relativos constante y superior, respectivamente, en las muestras evaluadas. El
aumento relativo del contenido de procianidina B1 para el cuarto día de
fermentación no es consistente con los resultados discutidos en el trabajo de
Wollgast y Anklam [6] en donde se evidencia una disminución del 42,62% en el
contenido de procianidinas totales en 4 días de fermentación; sin embargo, los
resultados de reducción relativa de procianidinas al final de la fermentación
obtenidos en este trabajo (alrededor del 65%), son cercanos a los discutidos
por Wollgast y Anklam [6] (alrededor del 54%).

Figura
9. Valores relativos de las sustancias
antioxidantes presentes en el clon de cacao CCN-51, respecto al nivel F2.
Discusión
Contenido de polifenoles totales (PT)
Evolución durante el beneficio. Un análisis general de la
Figura 1 permite establecer que la fermentación genera una disminución
pronunciada del contenido de PT, mientras que el secado no posee efecto definido.
Durante la fermentación del grano de cacao, los
polifenoles que están almacenados en las células pigmentadas de los
cotiledones, también llamadas células de almacenamiento de polifenoles, son
liberados junto con otros líquidos celulares. Según Wollgst y Anklam [6],
durante los primeros dos días de la fermentación, el mucílago adherido a los
granos se desprende y existe un aumento de temperatura. Bajo condiciones
anaeróbicas los microorganismos producen ácido acético y etanol.
Estos procesos inhiben la germinación del grano
y contribuye a los cambios estructurales en los granos fermentados, entre los
que se destacan la remoción de enzimas y sustratos. Los líquidos celulares se
mueven y atraviesan las paredes celulares y se distribuyen sobre todo el grano
de cacao. Para el tercer día, la masa de granos se habrá calentado
uniformemente a 45°C y se mantendrá entre esta temperatura y 50°C hasta que la
fermentación se haya completado.
Numerosos estudios han reportado la
proporcionalidad inversa del contenido de PT y el tiempo de fermentación del cacao, que se reconoce (junto al
tostado) como una de las etapas del procesamiento en que ocurre la mayor
pérdida de sustancias antioxidantes [1,3,8,26]. Así
mismo, estudios bibliográficos han concluido que la menor disminución de PT ocurre durante el secado natural [27,28].
Etapa
inicial (F0 y F2): En esta
región se ubicaron las muestras con
los contenidos más altos de PT. No obstante, los valores obtenidos en los granos sin fermentar (F0) se
encuentran por debajo de aquellos reportados en estudios similares. Así por
ejemplo, Tomas-Barberán et al. [29]
hallaron un contenido polifenólico total de 81,4mgEAG/gMS en un clon amazónico
colombiano seco y sin fermentar. Kim y Keeney [30] encontraron contenidos de PT en granos de cacao forastero no fermentado
entre 120 y 180mgEAG/gMS. Afoakwa et al.
[31] midieron el contenido de PT en híbridos de la variedad forastero y obtuvieron un valor de
180,87mgEAG/gMS. Por su parte, Serra Bonheví y Ventura [32] y Misnawi et al. [33] reportaron valores de PT de 135mgEAG/ gMS y
140mgEAG/gMS respectivamente, en granos de cacao fresco.
Adicionalmente, los polifenoles presentan
reacciones de oxidación que producen taninos condensados insolubles de alto
peso molecular [3]. Dichas reacciones son catalizadas por la enzima polifenol
oxidasa (PPO), con gran actividad en los granos en estado fresco. El hecho que
el contenido de PT de los granos de CCN-51 no fermentados haya resultado inferior al
reportado en varias fuentes bibliográficas, puede atribuirse a que el
procedimiento realizado para inactivar esta enzima no haya sido suficiente para
inhibirla al 100%. Esta hipótesis de trabajo se sustenta en el trabajo
realizado por Godoy [34], quien propone un método en el cual se optimizan las
condiciones que influyen en el proceso de inhibición (temperatura del
tratamiento térmico y concentración de inhibidor). Entre los resultados más
sobresalientes de Godoy [31], se destacan el ajuste de un modelo que
correlaciona el porcentaje de inhibición de la PPO y la recuperación de PT. Así mismo con base en las condiciones
optimizadas, se alcanza una inhibición superior al 90% para un clon de cacao
ICS91. Sin embargo, debe mencionarse que la tendencia seguida por el contenido
de PT en el
presente estudio durante los dos primeros días de fermentación, es concordante
con lo reportado por Gil [35].
En el trabajo de dicho autor se evidencia un
ligero aumento de la variable analizada entre el primer y el segundo día de
fermentación. Este aumento sugiere que las primeras reacciones tanto químicas
como enzimáticas del proceso fermentativo convierten algunos de los polifenoles
a formas más reductoras y activas al ensayo de Folin-Ciocalteu.
Se sugiere entonces para investigaciones
posteriores, la realización de análisis más específicos a las muestras
obtenidas en los primeros días de fermentación (p. ej. HPLC), con el fin de
establecer con total certeza el contenido real de PT.
Etapa intermedia (F4): Fue la única que presentó variación
con el factor secado, exhibiendo cambios significativos dentro del grupo.
Específicamente, para la muestra correspondiente a cuatro días de fermentación
y un día de secado (F4S1) se obtuvieron valores de PT por debajo del promedio del grupo, comparables con aquellos de la etapa
final de fermentación.a).
Etapa final (F6 y F8): En esta parte del proceso el
contenido de PT dejó de ser dependiente de los días de fermentación. Este hecho
coincide con lo reportado por Serra Bonheví et
al. [32], los cuales encontraron que en el intervalo de 5-6 días del
proceso de fermentación los PT llegaban a un valor estable de 43,1±1,87mgEAG/gMS. Durante su estudio
con frutos de cacao tipo Forastero, Efraim et
al. [27] encontraron una disminución de polifenoles del 59% al finalizar el
séptimo día de fermentación.
Así mismo, estos autores concluyeron que la
etapa de secado al sol sólo disminuye en un 2,8% el contenido de PT de semillas totalmente fermentadas. En el
presente estudio los PT se redujeron en un 50,1% al pasar del 1er al 8vo día de fermentación,
concordando con los resultados de estudios previos [1,3,8,26].
Modelo
matemático. Se observa
que el valor predicho para el nivel
0 de fermentación se aleja considerablemente del contenido de PT establecido en el presente estudio, acercándose
a su vez a lo reportado por otros autores [29-32].
Aunque la expresión propuesta en este trabajo
fue ajustada con valores propios del clon de cacao CCN-51, ella también permite
predecir la evolución del contenido de PT de variedades Forastero y Amazónico con un error relativo promedio del
20%, aproximadamente (Tabla 3). Incrementar el poder predictivo de la ecuación
planteada, así como extender su utilización para el cálculo de PT
en otras variedades de cacao puede lograrse
mediante la obtención de datos experimentales en
clones diferentes al CCN-51 que posteriormente serán utilizados en el
robustecimiento de los valores de las constantes aquí calculadas.
Tabla 3. Error relativo (ER) porcentual de
PT reportados por otros autores y
PT calculados con la ecuación planteada,
para diferentes muestras de cacao.

Capacidad Antioxidante (CA)
Evolución
durante el beneficio. Las
etapas que describen la variación de
la CA durante el
beneficio del clon CCN-51 pueden ser analizadas de forma similar al contenido
de PT: una etapa
inicial integrada por los niveles 0 y 2 de fermentación, caracterizada por los
valores más altos de CA y sin efecto pronunciado de la variable secado.
Seguida de una fase intermedia, correspondiente
al cuarto día de fermentación, en la que se observa incidencia significativa
del secado en los valores de CA. Por último, una etapa final que agrupa los niveles 6 y 8 de
fermentación, sin presencia de efecto del secado y en la que el valor de CA se estabiliza.
El promedio obtenido para la CA de todas las muestras evaluadas, determinada
por el método ORAC, fue de
668,09±272,70μmolTE/gMS. La desviación
estándar de 272,70 se traduce en un coeficiente de variación de 40,82%, el cual
se explica si se considera que los valores de CA variaron entre 969,42±68,44 y 404,20±53,00μmolTE/gMS para el inicio y final
de la fermentación.
En el caso de cacao sin procesamiento
industrial, Gil [35] encontró valores de ORAC de aproximadamente 450μmolTE/gMS
para muestras con 5 días de fermentación y 5 días de secado en cacao
colombiano, lo cual es equivalente con los resultados de CA obtenidos para la muestra F6S5
(451,43±43,16μmolTE/gMS).
Modelo
matemático. En el ajuste
de la expresión propuesta en este
trabajo se utilizaron valores propios del clon de cacao CCN-51. Sin embargo, se
verificó su capacidad de predicción de la CA en otras variedades de cacao. Para tal fin, los valores
de CA hallados por Gil [35] en su análisis de cacao colombiano con diferentes
días de fermentación, se compararon con aquellos predichos por la ecuación
planteada, obteniendo un error relativo porcentual del 20% (Tabla 4). Así las
cosas, se concluye que es posible usar la ecuación ajustada para predecir la CA de clones de cacao diferentes al CCN-51, así
como mejorar su nivel predictivo e incrementar su alcance mediante
experimentación con otras variedades de cacao.
Tabla 4.
Error relativo (ER) porcentual de la capacidad
antioxidante (CA) para cacao colombiano (fuente: Gil, 2012 [35]) y la CA calculada con la ecuación propuesta en el presente
trabajo.

Debe resaltarse que los resultados de CA reportados por Gil [35] no son del todo
concordantes con los reportados en el presente estudio.
Gil [35] reporta una disminución del valor de CA hasta el cuarto día de fermentación, seguido de
un incremento en el día quinto de dicho proceso.
Ese incremento concuerda con los valores de PT hallados por el autor mencionado, que también
aumentan entre el cuarto y quinto día del proceso fermentativo.
Tal como se observa en la Tabla 4, este hecho
hace que se generen los mayores porcentajes de error relativo entre el valor
calculado y el reportado por el Gil [32]. Ante lo cual se propone que los
experimentos posteriores (conducentes a incrementar el nivel predictivo del
modelo planteado) hagan especial énfasis en la parte final del proceso de
fermentación.
Relación entre la capacidad antioxidante y el contenido de polifenoles
totales
El contenido de PT y la CA han sido relacionados previamente por diferentes autores. Adamson et al. [36] y Gu et al. [2] reportaron una relación lineal entre la CA y el contenido de procianidinas, para diferentes productos de cacao,
con R2 de 0,994 y 0,923, respectivamente. Miller et al. [37] correlacionaron la CA determinada por el método ORAC con el contenido
de sólidos de cacao libres de grasa (NFCS de sus siglas en inglés) para diferentes
productos de chocolate y encontraron un R2 de 0,985. A su vez, el
contenido de NFCS fue directamente proporcional al contenido de PT
(R2=0,979). En su trabajo con licor
de cacao criollo,
trinitario, forastero y nacional, Counet et
al. [38] encontraron una correlación positiva entre el nivel de procianidinas y el tiempo de inhibición de la
oxidación por el método ORAC (R2=0,936). Los resultados obtenidos en
este estudio son comparables con los reportados por los autores mencionados,
teniendo en cuenta que las procianidinas forman parte de los polifenoles
típicos del cacao [38].
Separación e identificación de sustancias polifenólicas
La gran mayoría de sustancias presentes en los
extractos analizados pertenecen al grupo de los flavonoides, metabolitos
secundarios de las plantas y uno de los grupos más representativos de los
polifenoles [3]. Los granos de cacao son una fuente concentrada de polifenoles,
donde los flavan-3-oles y sus derivados presentan las mayores concentraciones
[31].
En las muestras analizadas estuvieron presentes
los flavan-3-oles (+)-catequina y (-)-epicatequina (monómeros) y las
procianidinas B1 y B2 (dímeros). Así mismo, se identificaron procianidinas en
formas oligoméricas. Estudios previos de varios autores han demostrado que los
flavanoles y dímeros ya mencionados son los más abundantes en el cacao y sus
derivados. Además, las procianidinas halladas son características del cacao y
del chocolate [39]. Estas últimas están constituidas por unidades de flavanoles
(epicatequina principalmente) con enlaces 4→6 o 4→8 formando una mezcla de trímeros, tetrámeros y polímeros de hasta 10
unidades [24,25,39-40]. Tanto los flavanoles como las
procianidinas han sido relacionados con las propiedades antioxidantes
atribuidas al cacao.
La variación de sustancias individuales a lo
largo de la fermentación permite asegurar que la CA de las muestras evaluadas se encuentra fuertemente influenciada por su
contenido de epicatequina. El otro monómero, catequina, no parece influenciar
significativamente dicha variable. Al respecto, Schroeter et al. [41] han reportado que el contenido de epicatequina es la
principal razón de los beneficios en la salud vascular asociados al cacao y al
chocolate. Así mismo, aseguran que la elección de un grano fermentado con alto
contenido en polifenoles (y por ende alta capacidad antioxidante, dada la
relación lineal existente entre PT y CA) depende en gran medida de su contenido
de epicatequina.
Conclusiones
De las etapas de beneficio del cacao, la
fermentación es la que mayor impacto genera en la variación del contenido de
polifenoles totales y la capacidad antioxidante del clon de cacao CCN-51. En
ambos casos se observó un comportamiento decreciente en relación con el proceso
fermentativo (disminución de 50,1% en el contenido de PT y de 58,3% en la CA). El análisis de resultados también permitió determinar, con un nivel
de confianza de 95%, que el secado natural tiene un efecto poco significativo
en las variables de respuesta seleccionadas. Teniendo en cuenta este hecho, se
establecieron dos modelos unifactor de tipo recíproco para predecir el
comportamiento de los polifenoles totales y la capacidad antioxidante en
función del tiempo de fermentación del clon CCN-51. Las ecuaciones planteadas
presentaron un buen grado de correlación (R2=0,963 para PT
y R2=0,959 para
CA) y fueron además satisfactoriamente aplicadas a
la evaluación del proceso fermentativo en clones de cacao de tipo Forastero y
Amazónico, con un porcentaje de error relativo promedio de aproximadamente 20%.
En el análisis por HPLC se identificaron los polifenoles presentes en las
muestras evaluadas.
La evaluación de su variación a través del
proceso fermentativo permitió establecer que el avance de esta etapa del
beneficio ocasiona una disminución en la mayoría de monómeros y oligómeros
presentes (excepto catequina y procianidina B1), que se traduce a su vez en una
disminución de la capacidad antioxidante de las muestras evaluadas. Dicha
disminución está relacionada principalmente con el contenido del monómero
epicatequina. El contenido de polifenoles totales y la capacidad antioxidante
del clon evaluado presentaron un tipo de correlación directamente proporcional
(R2=0,95).
La utilización comercial de los extractos
polifenólicos obtenidos a partir del clon no fermentado no queda reducida a la
industria de alimentos, sino que incluye también las industrias cosmética y
farmacéutica.
Agradecimientos
Los autores de este trabajo agradecen a la
Vicerrectoría de Investigación y Extensión por el apoyo económico ofrecido a
través del proyecto 5466 y 1318. Así mismo, los autores agradecen a Colciencias
por el apoyo recibido a través del programa de jóvenes investigadores e
innovadores.
Referencias
bibliográficas
[1]Payne M, Hurst J, Miller K, Rank C, Stuart D.
Impact of fermentation, drying, roasting and
dutch processing on epicatechin and catechin content of cacao beans and cocoa
ingredients. J Agric Food Chem. 2010;58(19):10518-27.
[2]Gu L, House S, Wu X, Ou B, Prior R. Procyanidin and catechin contents
and antioxidant capacity of cocoa and chocolate products. J Agric Food Chem.
2006;54(11):4057-61.
[3]Wollgast J, Anklam E. Review on polyphenols in Theobroma cacao: changes
in composition
during the manufacture of chocolate and methodology
for indentification and quantification. Food Res Int. 2000;33(6):423-47.
[4]Othman A, Ismail A, Ghani N, Adenan I. Antioxidant capacity and phenolic
content of cocoa beans. Food Chem. 2007;100(4):1523-30.
[5]Afoakwa E. Chocolate science and technology. 1st ed. New Delhi: John
Wiley & Sons Ltd; 2010.
[6]Wollgast J, Anklam E. Polyphenols in chocolate: is there a contribution
to human health?. Food Res Int. 2000;33(6):449-59.
[7]Rodriguez-Campos J, Escalona-Buendia H, Orozco-Avila I, Lugo-Cervantes
E, Jaramillo-Flores M. Dynamics of volatile and non-volatile compounds in cocoa
(Theobroma cacao L.) during
fermentation and drying processes using principal components analysis. Food Res
Int. 2011;44(1):250-8.
[8]Schinella G, Mosca S, Cienfuegos-Jovellanos E, Pasamar MA, Muguerza B,
Ramon D, et al. Antioxidant properties of polyphenol-rich cocoa
products industrially processed. Food Res Int. 2010;43(6):1614-23.
[9] Mayorga-Grossa AL, Quirós-Guerrero LM, Fourny G,
Vaillanta F. An untargeted metabolomics assessment of cocoa beans during
fermentation. Food Res Int. Apr 2016;
In press.
[10]
Garcia L,
Guarda D, Chavez J, Rios R, Chia J. Farmer participatory and on-station
selection activities carried out at Universidad Nacional
Agraria de la Selva, Peru. In: Eskes AB, editor.
Collavorative and participatory
approaches
to cocoa variety improvement. Final report of the CFC/ICCO/Bioversity
project on “Cocoa productivity and quality improvement: a participatory
approach” (2004-2010). CFC, Amsterdan, The Netherlands/ICCO, London,
UK/Bioversity International, Rome, Italy. p. 102-7.
[11]
Federación
Nacional de Cacaoteros Departamento de Investigación. Protocolo para
fermentación de muestras de cacao. May 2012.
[12]
Carrión-Santos
J. Estudio de factibilidad para la producción y comercialización de cacao (Theobroma cacao L.) variedad CCN-51,
Jama-Manabí. Quito, Ecuador: Universidad San
Francisco de Quito; 2012.
[13]
Maisincho-Asqui
MP. Fermentación de cacao (Theobroma
cacao) variedad CCN-51 inoculando Acetobacter. Ambato, Ecuador: Universidad
Técnica de Ambato; 2006.
[14]
Pallares-Pallares
A, Perea-Villamil JA, López-Giraldo LJ. Impacto de las condiciones de beneficio
sobre los compuestos precursores de aroma en granos de cacao (Theobroma cacao L) del clon CCN-51. Respuestas. 2016;21(1):120-33.
[15]
Pasamar MA,
Ibarra A, Cienfuegos-Jovellanos E, Laghi S, inventores/solicitantes.
Natraceutical Sa, solicitante. Proceso de obtención de extractos de cacao con
elevado contenido de polifenoles. España Patente WO 2007/138118 A1. 2007 Dic
06.
[16]
Cadena T,
Herrera Y. Evaluación del efecto del procesamiento del cacao sobre el contenido
de polifenoles y su actividad antioxidante (Trabajo de pregrado). Bucaramanga:
Universidad Industrial de Santander. Facultad de Química; 2008.
[17]
Wollgast J.
The contents and effects of polyphenols in chocolate. Qualitative and
quantitative analyses of polyphenols in chocolate and chocolate raw products as
well as evaluation of potential implications of chocolate consumption in human
health [Doctoral dissertation]. Gieβen: University of Gieβen. Faculty of
Agricultural and Nutritional Sciences; 2004.
[18]
Huang D, Ou
B, Hampsch-Wodill M, Flanagan J, Prior R. High-throughput assay of oxygen
radical absorbance capacity (ORAC) using a multichannel liquid handling system
coupled with a microplate fluorescence reader in 96-well format. J Agric Food
Chem. 2002;50(16):4437-44.
[19]
Cienfuegos-Jovellanos
E, Quiñones M, Muguerza B, Moulay L, Miguel M, Amaya A. Antihypertensive effect
of a polyphenol-rich cocoa powder industrially processed to preserve the
original flavonoids of the cocoa beans. J Agric Food Chem. 2009;57(14):6156-62.
[20]
Ki Won L,
Young Jun K, Hyong Joo L, Chang Young L. Cocoa has more phenolic phytochemicals
and a higher antioxidant capacity than teas and red wine. J Agric Food Chem.
2003;51(25):7292-5.
[21]
Prior R, Wu
X, Schaich K. Standardized methods for the determination of antioxidant capacity
and phenolics in foods and dietary supplements. J Agric Food Chem. 2005;53(10):4290-302.
[22]
Redovnikovic
I, Delonga K, Mazor S, Dragovic-Uzelac V, Caric M, Vorkapic-Furac J. Polyphenolic
content and composition and antioxidative activity of different cocoa liquors.
Czech J Food Sci. 2009;27(5):330-7.
[23] Wollgast J, Pallaroni L, Agazzi ME, Anklam E. Analysis of procyanidins
in chocolate by reversed-phase high-performance liquid chromatography with
electrospray ionisation mass spectrometric and tandem mass spectrometric
detection. J Chromatogr A. 2001;926(1):211-20.
[24] Efraim P, Tucci ML, Pezoa-Garcia NH, Haddad
R, Eberlin M. Teores de compostos fenólicos de sementes de cacaueiro de
diferentes genótipos. Braz J Food Technol. 2006;9(4):229-36.
[25] Hammerstone J, Lazarus S, Mitchell A, Rucker R, Schmitz H.
Identification of procyanidins in cocoa (Theobroma
cacao) and chocolate using high-performance liquid chromatography/ mass
spectrometry. J Agric Food Chem. 1999;47(2):490-6.
[26] Nazaruddin R, Seng L, Hassan O, Said M. Effect of pulp preconditioning
on the content of polyphenols in coco beans (Theobroma cacao) during
fermentation. Ind Crops Prod. 2006;24(1):87-94.
[27]
Efraim P,
Pezoa-Garcia NH, Jardim DCP, Nishikawa A, Haddad R, Eberlin MN. Influência da
fermentação e secagem de amêndoas de cacau no teor de compostos fenólicos e na
aceitação sensorial. Ciênc Tecnol Aliment. 2010;30(1):142-50.
[28]
Kyi TM, Wan
Daud WR, Mohammad AB, Wahid Samsudin M, Hassan Kadhum AA, Meor Talib MZ. The
kinetics of polyphenol degradation during the drying of malaysian cocoa beans.
Int J Food Sci Technol. 2005;40(3):323-31.
[29]
Tomás-Barbean
F, Cienfuegos-Jovellanos E, Marn A, Muguerza B, Gil-Izquierdo A, Cerd B, et al. A new process to develop a cocoa
powder with higher flavonoid monomer
content and enhanced bioavailability in healthy humans. J Agric Food Chem. May
2007; 55(10): 3926-35.
[30]
Kim H, Keeney
P. (-)-Epicatechin content in fermented and unfermented cocoa beans. J Food
Sci. 1984;49(4):1090-2.
[31]
Afoakwa E,
Quao J, Takrama F, Budu A, Saalia F. Changes in total polyphenols, o-diphenols
and anthocyanin concentrations during fermentation of pulp pre-conditioned
cocoa
(Theobroma cacao) beans. Int Food Res J. 2012;19(3):1071-7.
[32]
Serra Bonvehi
J, Ventura Coll F. Evaluation of bitterness and astringency of polyphenolic
compounds in cocoa powder. Food Chem. 1997;60(3):365-70.
[33]
Misnawi JS,
Jamilah B, Nazamid S. Oxidation of polyphenols in unfermented and partly
fermented cocoa beans by cocoa polyphenol oxidase and tyrosinase. J Sci Food
Agric. Apr 2002;82(5):559-66.
[34] Godoy Chivatá JE. Obtención de
antioxidantes a partir de grano de cacao: condiciones favorables de
inactivación de la enzima polifenol oxidasa, extracción de polifenoles y ajuste
de parámetros cinéticos (Trabajo de pregrado). Bucaramanga, Colombia: Universidad
Industrial de Santander; 2015.
[35]
Gil Quintero
JA. Estabilidad y actividad antioxidante de catequinas presentes en cacaos
colombianos durante los proceso s de pre
industrialización (Tesis de Maestría). Medellin: Universidad de Antioquia.
Facultad de Química Farmaceutica; 2012.
[36]
Adamson G,
Lazarus S, Mitchell A, Prior R, Cao G, Jacobs P, et al. HPLC method for the quantification of procyanidins in cocoa
and chocolate samples and correlation to total antioxidant capacity. J Agric
Food Chem. 999;47(10):4184-8.
[37]
Miller K,
Stuart D, Smith N, Lee C, McHale N, Flanagan J, et al. Antioxidant activity and polyphenol and procyanidin contents
of selected commercially available cocoa-containing and chocolate products in
the United States. J Agric Food Chem. 2006;54(11):4062-8.
[38]
Counet C,
Ouwerx C, Rosoux D, Collin S. Relationship between procyanidin and flavor
contents of cocoa liquors from different origins. J Agric Food Chem. 2004;52(20):6243-9.
[39]
Ortega N,
Romero MP, Macia A, Reguant J, Angles N, Morello JR, et al. Obtention and characterization of phenolic extracts from
different cocoa sources. J Agric Food Chem. 2008;56(20):9621-7.
[40]
Counet C,
Collin S. Effect of the number of flavanol units on the antioxidant activity of
procyanidin fractions isolated from chocolate. J Agric Food Chem. 2003;51(23):6816-22.
[41]
Schroeter H,
Heiss C, Balzer J, Kleinbongard P, Keen C, Hollenberg N, et al. (-)-Epicatechin mediates beneficial effects of flavanol-rich
cocoa on vascular function in humas. Proc Natl Acad Sci U S A. 2006;103(4):1024-9.
Cita: Pallares Pallares PA, Estupiñán MR, Perea
Villamil JA, López Giraldo LJ. Impacto de la fermentación y secado sobre el
contenido de polifenoles y capacidad
antioxidante del clon de cacao CCN-51. rev.ion. 2016;29(2):7-21
![]()









![]()




