http://dx.doi.org/10.18273/revsal.v51n4-2019001
Artículo científico
Cambios en el perfil proteómico de preadipocitos con
diferentes condiciones metabólicas
Changes in the proteomic pro ile of preadipocytes with different
metabolic status
ile of preadipocytes with different
metabolic status
Natalia R Moreno Castellanos[1]
Universidad Industrial de
Santander. Bucaramanga, Colombia.
Correspondencia: Natalia Moreno-Castellanos.
Dirección: Facultad de salud, carrera 32 No. 29-31, Ed. administrativo 1, Piso
1 Of. 205. Teléfono: +57 3222458530 Correo electrónico: Email: nrmorcas@uis.edu.co
Resumen
Introducción
y objetivos: El tejido adiposo subcutáneo se considera un depósito con un
papel protector desde un punto de vista metabólico. El exceso de tejido adiposo
desencadena en obesidad, la cual, está acompañada típicamente por resistencia a
insulina, dislipidemia, e hipertensión arterial. No obstante, se conoce que
existe un subgrupo de obesos que parecen estar protegidos de dichas complicaciones.
Estos individuos son definidos como obesos sanos metabólicamente. A pesar de
los avances en el conocimiento de las alteraciones que suceden en el tejido
adiposo en obesidad, aún se desconocen los mecanismos que subyacen en el
desarrollo de resistencia a insulina. Por lo tanto, en este trabajo, se estudió
la asociación entre obesidad y desarrollo de enfermedad metabólica
identificando factores y procesos que determinan la transición desde el
fenotipo obeso sano y no sano, empleando preadipocitos provenientes de tejido
adiposo subcutáneo.
Metodología:
Se emplearon datos de un estudio de proteómica comparada de
preadipocitos de tejido subcutáneo obtenidos de pacientes obesos
normoglucémicos no resistentes a insulina y de pacientes obesos con diabetes mellitus
de tipo 2. El estudio proteómico, se llevó a cabo utilizando la técnica de
iTRAQ combinada con LC-MSMS.
Resultados
y conclusiones: Las diferencias entre preadipocitos de tejido adiposo
subcutáneo en sujetos normoglucémicos y con diabetes, afectan sobre todo a
proteínas citosólicas y, en particular, a proteínas relacionadas con procesos
metabólicos mientras que, las membranales no cambian entre fenotipos obesos. En
el estudio se identificaron importantes diferencias en el perfil proteómico de
los preadipocitos de tejido adiposo subcutáneo en obesidad, tanto en sujetos
normoglucémicos como diabéticos, apoyando la importancia de estas células en el
mantenimiento de la identidad del depósito graso. También se encontró que, la
transición desde el fenotipo obeso sano hacia el no sano conlleva un mayor
desarrollo de estrés oxidativo e inflamación en las células precursoras
adipocitarias.
Palabras clave: Preadipocito; obesidad; proteómica;
normoglucemia; diabetes; tejido adiposo subcutáneo.
Abstract
Introduction
and objectives: The subcutaneous adipose tissue is considered as a depot
with a protective role from a metabolic point of view. An excess of adipose
tissue is triggered in obesity, which is accompanied by insulin resistance,
dyslipidemia and arterial hypertension. However, it is known that, there is a
subgroup of obese people who seem to be protected from obese complications.
These individuals are defined as metabolically healthy obese. Despite the
advances in the knowledge of the alterations that occur in adipose tissue
during obesity, the mechanisms underlying the development of insulin resistance
are still unknown. Therefore, in this work, we studied the association between
obesity and the development of metabolic disease, we identified factors and processes
that determined the transition of healthy and unhealthy obesity phenotype,
using preadipocytes from subcutaneous adipose tissue.
Methods:
Data obtained from a comparative proteomics study of subcutaneous adipose
tissue preadipocytes from normoglycemic obese patients-not resistant to insulin
and from obese patients with type 2 diabetes mellitus were used. The proteomic
study was carried out using the iTRAQ combined with LC -MSMS.
Results
and conclusions: The differences between pre-adipocytes of subcutaneous
adipose tissue in normoglycemic subjects and with diabetes affect mainly
cytosolic proteins and, in particular, proteins related to metabolic processes
while, membrane proteins do not change between obese phenotypes. In this study,
we identified significant differences in the proteomic profile of preadipocytes
from subcutaneous adipose tissue in obesity in both, normoglycemic and diabetic
subjects, supporting the importance of these cells in the maintenance of the
fat depot identity. We also found that, the transition from unhealthy to
healthy phenotype in obesity, leads to further development of oxidative stress
and inflammation in adipocyte precursor cells.
Keywords: Preadipocyte; obesity; proteomic;
normoglycemia; diabetes; subcutaneous adipose tissue.
Recibido: 24/05/2019
Aprobado: 02/09/2019
Publicado online: 10/09/2019
Introducción
El tejido adiposo constituye el depósito energético más
importante del organismo. Almacena el exceso energético en forma de
triglicéridos (TAGs), que son liberados de forma controlada en condiciones de
déficit de energía y utilizados por otros órganos y tejidos corporales. Además,
constituye un sitio fundamental de utilización de glucosa, que es empleada para
producir la energía necesaria para el metabolismo celular y para esterificar
los ácidos grasos (AGs) con glicerol, formando así los TAGs1,2. Destaca por otro
lado su función endocrina3,
llevada a cabo por medio de la producción de una enorme variedad de moléculas
señalizadoras, las adipoquinas, que regulan desde la ingesta y la homeostasis
energética hasta la reproducción, estableciendo también un importante diálogo
con el sistema inmunitario y cardiovascular1,2.
El tejido adiposo está constituido por adipocitos maduros,
que representan el componente celular principal del mismo, y por la denominada
Fracción de Estroma Vascular (FEV), siendo ambos componentes fundamentales para
la función del mismo. La FEV está integrada por las Células Madre Mesenquimales
(MSCs) y preadipocitos que permiten la renovación del tejido, así como
terminaciones nerviosas, diversos tipos de células sanguíneas (macrófagos,
linfocitos T y B, neutrófilos) y tejido vascular2.
El tejido adiposo se distribuye en diferentes depósitos
corporales, siendo los depósitos de Tejido Adiposo Visceral (TAV) y Subcutáneo
(TASC) los más importantes. Ambos depósitos difieren en su distribución, sus
propiedades moleculares, metabólicas y su perfil secretor2.
En particular, el TASC, se localiza bajo la piel y a lo largo
de todo el cuerpo, en condiciones normales, se caracteriza por mantener una
elevada producción de adiponectina (con funciones insulino-sensibilizantes) y
baja producción de citoquinas pro-inflamatorias (IL6, TNF-α)4.
Actualmente se sabe que el incremento de tejido adiposo que
se produce con la obesidad se suele asociar a resistencia a insulina, siendo
esta un factor de riesgo independiente para el desarrollo de diabetes tipo 2,
enfermedad cardiovascular, dislipemia, hipertensión (enfermedades y factores de
riesgo del síndrome metabólico) y diferentes tipos de cáncer5. El aumento del tejido
adiposo se produce por hiperplasia (generación de nuevos adipocitos a partir de
precursores/preadipocitos como resultado del recambio de adipocitos tras la
adolescencia) la cual se mantiene en individuos delgados y obesos en la edad
adulta6 e
hipertrofia (incremento de tamaño)7.
no son hipertensos y presentan perfiles inmunológicos,
hormonales, de inflamación, de lípidos y de enzimas del hígado favorables, en
contraposición con las personas obesas con enfermedad metabólica (MUHOMetabolically
Unhealthy Obese)12,13.
El TAV sufre una mayor infiltración de linfocitos y
macrófagos que el TASC en la obesidad2 de manera que la acumulación de TAV está
estrechamente relacionada con el desarrollo de insulino-resistencia y
enfermedad cardiovascular8. Por el contrario, el TASC se ha llegado a
considerar un protector metabólico9. La obesidad se considera hoy en día como
un estado crónico de inflamación de bajo grado y de alteración del patrón de
hormonas secretadas por el tejido adiposo, lo que explicaría la
etiología del desarrollo de insulino-resistencia9. La inflamación asociada a
la obesidad puede ser el detonante de diferentes procesos de estrés celular en
el adipocito1,10 que frecuentemente desencadenan en resistencia a
insulina, dislipidemia, e hipertensión arterial. No obstante,
actualmente se sabe que existe un subgrupo de obesos (entre el
25-30%) que parecen estar protegidos frente a dichas complicaciones11.
A pesar de presentar un exceso de grasa corporal (índices de masa
corporal superiores a 40 kg/m2), estos individuos, definidos como obesos
metabólicamente sanos (MHO-Metabolically Healthy Obese), son sensibles
a insulina, normoglucémicos, no son hipertensos y presentan perfiles
inmunológicos, hormonales, de inflamación, de lípidos y de enzimas del hígado
favorables, en contraposición con las personas obesas con enfermedad
metabólica (MUHO-Metabolically Unhealthy Obese)12,13.A pesar de los
avances recientes en el conocimiento de las alteraciones que suceden en el
tejido adiposo en obesidad, aún no se conocen totalmente los mecanismos que
subyacen en el desarrollo de resistencia a insulina en condiciones de obesidad
en el tejido adiposo. Teniendo en cuenta lo mencionado previamente, este
artículo, pretende profundizar en el estudio de la asociación entre
obesidad y desarrollo de enfermedad metabólica, principalmente en preadipocitos
provenientes de TASC de sujetos obesos normoglucémicos (NG)/MHO y sujetos
obesos con diabetes tipo 2 (DM)/MUHO, utilizando como punto de partida la
identificación de los factores y procesos que determinan la transición desde el
fenotipo MHO a MUHO en obesidad.
A pesar de los avances recientes en el conocimiento de las
alteraciones que suceden en el tejido adiposo en obesidad, aún no se conocen
totalmente los mecanismos que subyacen en el desarrollo de resistencia a
insulina en condiciones de obesidad en el tejido adiposo.
Teniendo en cuenta lo mencionado previamente, este artículo,
pretende profundizar en el estudio de la asociación entre obesidad y desarrollo
de enfermedad metabólica, principalmente en preadipocitos provenientes de TASC
de sujetos obesos normoglucémicos (NG)/MHO y sujetos obesos con diabetes tipo 2
(DM)/MUHO, utilizando como punto de partida la identificación de los factores y
procesos que determinan la transición desde el fenotipo MHO a MUHO en obesidad.
Materiales y métodos
Selección de pacientes y diseño del estudio
Se seleccionaron 12 pacientes obesos, a los que se
les extrajeron muestras pareadas de Tejido Adiposo Subcutáneo (TASC)
mediante cirugía bariátrica (n =12). Se utilizaron dos grupos de estudio: I)
Sujetos obesos normoglucémicos (NG) (n=6), con un nivel de glucosa en sangre en
ayunas entre 70 y 100 mg / dl y un índice HOMA inferior a 3; y II) Sujetos
obesos diabéticos (DM) (n=6), con un nivel de glucosa en sangre en
ayunas mayor de 126 mg / dl y un índice HOMA superior a 3. Los sujetos con DM
no estaban en tratamiento con insulina o medicación que pudiera afectar los
parámetros bioquímicos.
Ensayos
bioquímicos
Los ensayos bioquímicos y hormonales realizados en los
sujetos del estudio se midieron como se describió previamente14 siguiendo los
criterios de los fabricantes para los kits comerciales. Los parámetros
bioquímicos y antropométricos de los sujetos que formaron parte del
estudio se muestran en la Tabla 1. El índice de resistencia insulínica (HOMA-IR)
fue calculado como (insulina*glucosa) /405
Dispersión de tejido adiposo, separación de
adipocitos maduros y de fracción de estroma vascular
La separación del tejido adiposo se realizó siguiendo el
protocolo descrito previamente15. Para llevar a cabo los estudios, se recogieron muestras
de TASC sumergiéndose en medio de cultivo estéril.
El tejido se cortó en trozos de aproximadamente 1-3 mm3 y se digirieron con
colagenasa (10 μL/g de tejido adiposo) durante 1 h a 37ºC en agitación. La
suspensión celular se filtró a través de un filtro (tipo cell strainer) de 100
μm de poro, seguido por centrifugación (900 rpm durante 10 min). Al terminar la
centrifugación, se recogió una capa blanca flotante correspondiente a los
adipocitos maduros, los adipocitos maduros se congelaron en nitrógeno líquido y
fueron almacenados a -80ºC; por otro lado, el sedimento celular correspondiente
a la fracción de estroma vascular (FEV) se resuspendió en 5 mL de medio de
dispersión (DMEM/F-12 suplementado con biotina 16μM, ácido ascórbico 100 μM,
antibiótico/ antimicótico pasándose posteriormente a través de un filtro de 40
μm de poro. Se centrifugó (950 rpm, 10 min) y el sedimento se trató durante 5
minutos con 500 μL de tampón de lisis de eritrocitos (RBC Lysis solution). Se realizó
una nueva centrifugación (950 rpm, 10 min) para obtener los preadipocitos del
tejido, resuspendiéndose el sedimento celular para sembrarse en frascos con
medio de mantenimiento (DMEM/F-12 suplementado al 10% de suero fetal bovino
(FBS) con glucosa al 17,5 mM, biotina 16 μM, ácido pantoténico 18 μM,
antibiótico/antimicótico.
Cultivo de preadipocitos
Pasadas 48 horas de cultivo, el medio de cultivo fue
remplazado por medio de mantenimiento, renovando el mismo cada dos o tres días
hasta alcanzar confluencia (5–7 días). Una vez confluentes, se levantaron las
células (preadipocitos) con tripsina-EDTA y se sembraron en placas de 35 mm a
una densidad de 5.000 células/pocillo. Las células fueron cultivadas en medio
de mantenimiento suplementado al 10% (v/v) de FBS durante 3 días hasta alcanzar
confluencia para la realización de los ensayos posteriores.
Proteómica comparativa (iTRAQ)
Los preadipocitos obtenidos del cultivo de FEV fueron
tratadas con urea 8 M, CHAPS 4%, Tris 30 mM, sonicadas y cuantificadas. Se
adicionó ditiotreitol (DTT) 2 mM y yodoacetamida (IAA) 7 mM para la reducción y
alquilación. Cada grupo de muestras fue tratado con TCA y posteriormente fueron
digeridas con tripsina 2%. Cada grupo fue marcado con su correspondiente
reactivo de iTRAQ: iTRAQ 116 (muestras de sujetos NG) y iTRAQ 117 (muestras de
sujetos DM), el protocolo se realizó según las instrucciones del fabricante.
Posteriormente, las muestras fueron secadas y resuspendidas en fase de
inyección y los extractos fueron diluidos con una mezcla de metanol 5% y ácido
fórmico 1% analizándose por LC-MS/MS, usando un espectrómetro de masas Orbitrap
XL (ThermoFisher) equipado con una interfaz de ionización microESI (Proxeon).
El sistema cromatográfico consistió en un cartucho de preconcentración C18
(Agilent Technologies) conectado a una columna C18 de 15 cm con diámetro
interno de 100 µm (Nikkyo Technos Co.). La separación se realizó con un
gradiente de acetonitrilo de 3 a 40% (0,4 μL/min durante 90 min). Los espectros
obtenidos fueron analizados en SEQUEST (Proteome Discoverer v1.3 ThermoFisher).
La búsqueda se realizó con una base de datos que incluye proteínas humanas
(Uniprot taxonomy 9606).
A partir de los datos generados por el estudio proteómico
mediante iTRAQ, se analizaron las funciones, características y redes de
interacción de las proteínas identificadas utilizando la base de datos
incluidas en la web de Genecards (http://www.genecards.org) y los softwares
Panther (http://www.pantherdb.org) e Ingenuity Pathway Analysis (IPA) (http://www.
ingenuity.com/products/ipa).
Análisis estadístico
Todos los datos están representados como Media ± SEM. La
significación estadística entre dos medias fue evaluada por Mann-Whitney y
T-test para muestras no pareadas. Se tuvo en cuenta un p < 0,05 como
criterio para la significación. Todos los gráficos y análisis se realizaron
utilizando el paquete estadístico SPSS 15.0.
Resultados
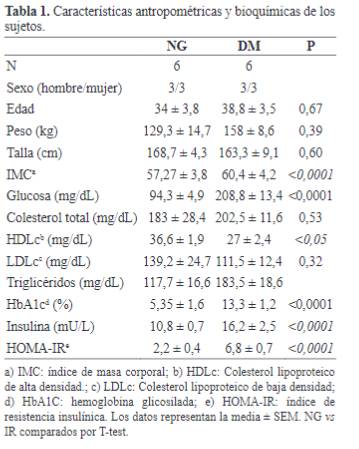
En los datos paramétricos y bioquímicos de los sujetos de
estudio se encontró que el índice de masa corporal (IMC) era superior a 40 Kg/m2, lo que incluye a los
dos grupos de pacientes (NG y DM) dentro de una población de sujetos obesos
mórbidos. Sin embargo, el grupo de pacientes DM tenían un IMC superior a los
sujetos NG (P<0,0001). Las diferencias en los parámetros de glucosa,
hemoglobina glicosilada (HbA1C), insulina e índice de resistencia insulínica
(HOMA-IR), demuestran las claras diferencias durante la clasificación de los
dos grupos de estudio, obesos mórbidos normoglucémicos (NG) y obesos mórbidos
con diabetes mellitus tipo 2 (DM). El colesterol lipoproteíco de alta densidad
(HDLc) presentó diferencias significativas (P<0,05) entre los dos grupos de
pacientes que hacían parte del estudio.
En el ensayo iTRAQ se obtuvieron un total de 781 proteínas
en el proteoma global de los preadipocitos. Estas proteínas fueron clasificadas
de acuerdo a su
localización y función con la base de datos de Ingenuity
proteínas) estaban localizadas en el núcleo, 12% (30 Pathways Analysis (IPA) y
Panther. Respecto a su proteínas) en la membrana plasmática y un 9% (19
localización, se pudo asignar la localización intracelular proteínas) en el
espacio extracelular, estos datos se de 374 proteínas, entre las cuales el 53%
(268 proteínas) evidencian en la Figura 1A. correspondían a proteínas
citoplasmáticas, 26% (57
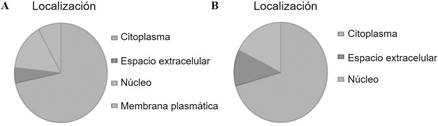
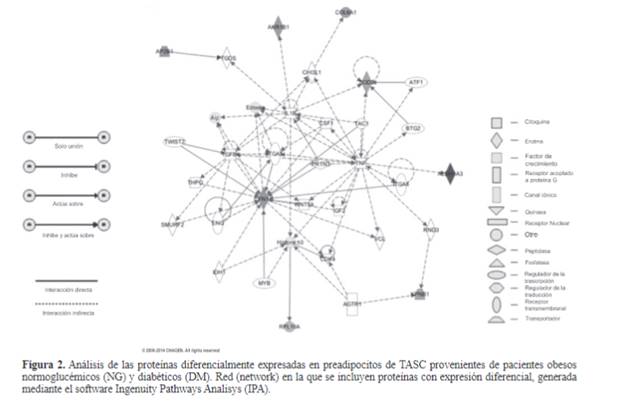
Figura 1.
Localización de proteínas identificadas. A- Clasificación de las proteínas
según su localización celular. B-Clasificación de proteínas diferencialmente
expresadas entre sujetos obejos normoglucémicos y sujetos obesos diabéticos.
Datos extraídos del software Ingenuity Pathway Analysis (IPA) y de la
base de datos Panther.
Preadipocitos de TASC de pacientes obesos normoglucémicos vs. Pacientes
obesos con DM
Se identificaron 17 proteínas que se encuentran enlistadas
en la Tabla 2. Estas 17 proteínas, fueron expresadas diferencialmente en
pre adipocitos provenientes de pacientes obesos DM y NG, de las cuales 16 se
encontraban aumentadas en DM y 1 en NG. El análisis IPA reveló que el 70% de las
proteínas se encuentran localizadas en citoplasma (12 proteínas), el 12% en el
espacio extracelular (2 proteínas) y el 18% (3 proteínas) se encuentran en el
núcleo, Figura 1B.
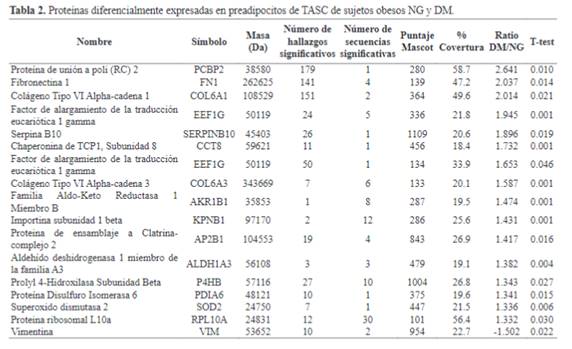
la red “Señalización e interacción celular, desarrollo del
tejido”; entre éstas se encuentran dos proteínas sobre las que confluyen varias
interacciones, FN1, involucrada en la producción de matriz extracelular y en
procesos inflamatorios, y SOD2, relacionada con estrés oxidativo, estos datos
se encuentran en la Tabla 3.
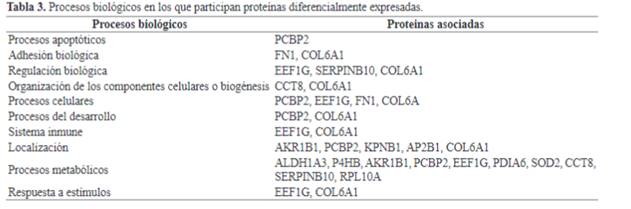
TNFα ocupa un lugar central en la red de interacciones entre
las proteínas. Curiosamente, en la red definida por las proteínas aumentadas en
DM también se incluye la única proteína que se encontró disminuida en dichos
pacientes, RPL10A (sombreada en la red de interacción de la Figura 2).
utilizando como modelo la línea celular 3T3-L116–18. Los escasos
estudios realizados con preadipocitos humanos han empleado otras técnicas
proteómicas y estaban centrados bien en el análisis comparativo de
preadipocitos antes y después del proceso de diferenciación19 o bien en establecer
el proteoma de la membrana de los preadipocitos20, sin hacer además referencia al peso de
los donantes. De la misma manera, se han empleado otras técnicas proteómicas
para el análisis del proteoma global o de diferentes compartimentos celulares
(membrana plasmática, núcleo, etc) de preadipocitos 3T3-L1 o de ratón21. En conjunto, éste
estudio permitió identificar un total de 781 proteínas del proteoma de los
preadipocitos humanos, lo que se sitúa un poco por debajo de lo obtenido sobre
el proteoma global de células 3T3-L121, aunque esos estudios se destinaron
específicamente a la determinación del proteoma, no para establecer
comparativas como es el caso de este estudio.
A partir del listado de proteínas identificadas, procedimos
a analizar su función, características moleculares y distribución, usando tres
tipos de bases de datos: Genecards, Panther e Ingenuity Pathway Analysis
(IPA). En particular, el análisis IPA reconoció 781 proteínas diferentes en el
proteoma de preadipocitos humanos, que corresponden fundamentalmente a
proteínas citoplasmáticas, nucleares, asociadas a la membrana plasmática o
productos de secreción (i.e., de la matriz extracelular). No obstante, para un
relativamente elevado número de proteínas no se pudo asignar su asociación a
ningún compartimento celular.
El depósito de TASC muestran importantes diferencias
moleculares, bioquímicas y celulares, que se reflejan en su distinta fisiología22. Nuestros estudios
permiten añadir nuevas diferencias entre los preadipocitos TASC en individuos
obesos para identificar puntos de comparación entre obesos NG y con DM.
Un estudio de la fracción de estroma vascular (FEV) (que
incluye células mesenquimales, preadipocitos, células inmunes, etc) demostró
que existen diferencias entre TASC y TAV entre sujetos delgados23. En dicho estudio,
realizado mediante 2D-PAGE (aplicado a FEV, tejido adiposo total y adipocitos
aislados), se concluía que la FEV contribuye de manera importante a mantener las
diferencias entre los depósitos de tejido adiposo23. Los resultados del estudio comparativo
de iTRAQ amplían esta idea, al demostrar que en los preadipocitos provenientes
de TASC, se conservan diferencias dependientes del fenotipo obesos, ya sea,
obesidad en condiciones de sensibilidad a insulina (NG) como de diabetes de
tipo 2 (DM). Concretamente, la FEV de TASC de individuos delgados difieren en
proteínas relacionadas con el plegamiento (chaperonas), el citoesqueleto y
procesos asociados a membrana (lamina, ezrina, etc), o el mantenimiento del
estado redox (varias isoformas de ALDH1)23,24. Nuestro estudio muestra que, en
individuos obesos NG, las diferencias entre preadipocitos de TASC afectan sobre
todo a proteínas citosólicas y, en particular, a proteínas implicadas en
procesos metabólicos. También observamos diferencias en relación a procesos de
regulación biológica. Al observar detalladamente los datos, se puede observar
que en todos los procesos biológicos se encuentran una o varias proteínas que hacen
parte de la matriz extracelular y algunas proteínas del citoesqueleto
(vimentina). Estas observaciones podrían estar de acuerdo con la importancia en
la respuesta de las células, en particular en la respuesta a insulina25.
Uno de los resultados comunes en preadipocitos de TASC en
los dos grupos de pacientes, es que no se encontraron diferencias en proteínas
de la membrana plasmática en la transición de NG a DM, lo que sugiere que esta
estructura puede estar sometida a menos cambios que otros componentes celulares
en dicha transición.
Entre las proteínas aumentadas en preadipocitos TASC de
obesos DM con respecto a obesos NG se identificaron varias relacionadas con la
regulación de procesos metabólicos, lo que sugiere que estos presumiblemente
determinan la diferencia entre la situación NG y DM. Adicionalmente,
identificamos la proteína SOD2 (superóxido dismutasa 2), una proteína
mitocondrial fundamental en la eliminación del daño oxidativo que protege de la
oxidación a los componentes de la cadena respiratoria y otros constituyentes
celulares24,26.
El aumento de SOD2 en DM apoya la idea de la existencia de un mayor daño
oxidativo en estas condiciones que el existente en preadipocitos de sujetos
obesos NG. De hecho, existe una clara correlación positiva entre el incremento
del tejido adiposo y el estrés oxidativo de éste27. Nuestros datos en preadipocitos
concuerdan con esta última hipótesis. Puesto que, aunque los dos grupos de
pacientes son obesos mórbidos, los sujetos con DM tienen un IMC superior a los
NG, podrían tener un mayor nivel de daño oxidativo asociado al peso adicional
respecto a los pacientes NG, a pesar del aumento en la expresión de algunas
proteínas con capacidad antioxidante como un posible efecto compensatorio.
En esta línea, dentro de los resultados relevantes
proporcionados por el análisis IPA es que las redes de interacción en la que
están incluidas las proteínas con expresión diferencial en TASC, tanto en
individuos obesos NG como DM, sitúan a un marcador de inflamación (TNFα) en el
centro de dichas interacciones. En este sentido hay que indicar que, aunque se
ha propuesto que la obesidad sin complicaciones metabólicas (NG) presenta
niveles menores de inflamación en el tejido adiposo que la obesidad
metabólicamente comprometida (MHO vs. MUHO)24,28, lo cierto es que, el incremento de
tejido adiposo produce ya de por sí el desarrollo de un estado de inflamación
crónico29. Es
posible que, en condiciones de diabetes, en los que encontramos por ejemplo
mayores niveles el Factor Inhibidor de la Migración de macrófagos (MIF), el
grado de inflamación sea superior al existente en el tejido adiposo de obesos
NG o, alternativamente, que los preadipocitos de TASC sean capaces de adaptarse
a las condiciones de inflamación (y de estrés celular en general) de manera
eficaz. No obstante lo anterior, hay que indicar que la mayoría de los estudios
relacionados con las diferencias proteómicas en relación a la obesidad y la
resistencia a insulina se han llevado a cabo sobre muestras de tejido adiposo
total, por lo que recogen cambios tanto en los preradipocitos como en los
adipocitos y otros componentes del tejido a diferencia de nuestro estudio
realizado que recoge la información de los preadipocitos de TASC.
Finalmente, se puede concluir que, existen importantes
diferencias en el perfil proteómico de los preadipocitos de TASC en obesidad,
tanto en condiciones de sensibilidad a insulina como de diabetes, lo que apoya
la importancia de estas células en el mantenimiento de la identidad de cada
depósito y que, la transición desde el fenotipo NG a DM en obesidad conlleva un
mayor desarrollo de estrés oxidativo e inflamación desde los precursores
adipocitarios.
Agradecimientos
Este trabajo fue financiado por MINECO / FEDER
(BFU2010-17116); Fue apoyado por el programa de movilidad de la Universidad
Industrial de Santander, programa académico eventos internacionales 2018
(2051). Agradecemos a María Malagón del IMIBIC por el suministro de muestras,
Jana Alonso [Plataforma proteómica del Instituto de Investigación en Salud de
Santiago (IDIS), Universidad de Santiago de Compostela, España] y las
Instalaciones de Proteómica del IMIBIC / Universidad de Córdoba-SCAI
(ProteoRed, PRB2-ISCIII, apoyada por la beca PT13 / 0001)
por su ayuda con los estudios iTRAQ.
Consideraciones éticas
Todos los experimentos se realizaron teniendo en cuenta los
criterios de la declaración de Helsinki. Los apartados éticos del estudio, así
como el diseño experimental fueron debidamente aprobados por el comité
encargado de la investigación (073/2013) del Hospital Reina Sofía, España, se
contó con el consentimiento informado de todos los voluntarios.
Conflicto de interés
Los autores confirman que no tienen ningún conflicto de
interés.
Referencias
1.
Malagon M, Díaz-Ruiz A, Guzman-Ruiz R, Jimenez-Gomez Y, Moreno N,
Garcia-Navarro S, et al. Adipobiology for Novel Therapeutic Approaches in
Metabolic Syndrome. Curr Vasc Pharmacol. 2014; 11(6): 954-967.
2.
Anaizi N. Fat facts: An overview of adipose tissue and lipids.
Ibnosina J Med Biomed Sci. 2019; 11(1): 5-15.
3.
Schoettl T, Fischer IP, Ussar S. Heterogeneity of adipose tissue
in development and metabolic function. J Exp Biol 2018; 221. (Pt Suppl 1). doi:
10.1242/jeb.162958.
4.
Vohl M-C, Sladek R, Robitaille J, Gurd S, Marceau P, Richard D,
et al. A survey of genes differentially expressed in subcutaneous and visceral
adipose tissue in men. Obes Res. 2004; 12(8): 1217-1222. doi:
10.1038/oby.2004.153.
5.
Ekpenyong CE. Relationship between Insulin Resistance and
Metabolic Syndrome Clusters: Current Knowledge. Acta Sci Med Sceinces. 2019;
3(3): 99-104.
6.
Spalding KL, Arner E, Westermark PO, Bernard S, Buchholz BA,
Bergmann O, et al. Dynamics of fat cell turnover in humans. Nature. 2008;
453(7196): 783-787. doi: 10.1038/nature06902.
7.
Rosen ED, MacDougald OA. Adipocyte differentiation from the
inside out. Nat Rev Mol Cell Biol. 2006; 7(12): 885-896. doi: 10.1038/nrm2066.
8.
Hamdy O, Porramatikul S, Al-Ozairi E. Metabolic obesity: the
paradox between visceral and subcutaneous fat. Curr Diabetes Rev. 2006; 2(4):
367-373.
9.
Virtue S, Vidal-Puig A. Adipose tissue expandability,
lipotoxicity and the metabolic syndrome — An allostatic perspective. Biochim
Biophys Acta. 2010; 1801(3): 338-349. doi: 10.1016/j. bbalip.2009.12.006.
10.
Maury E, Brichard SM. Adipokine dysregulation, adipose tissue
inflammation and metabolic syndrome. Mol Cell Endocrinol. 2010; 314(1): 1-16.
doi: 10.1016/j.mce.2009.07.031.
11.
Xu XJ, Pories WJ, Dohm LG, Ruderman NB.
What distinguishes adipose tissue of severely obese humans
who are insulin sensitive and resistant? Curr Opin Lipidol. 2013; 24(1) :
49-56. doi: 10.1097/ MOL.0b013e32835b465b.
12.
Primeau V, Coderre L, Karelis AD, Brochu M, Lavoie M-E, Messier
V, et al. Characterizing the profile of obese patients who are metabolically
healthy. Int J Obes. 2011; 35(7): 971-981. doi: 10.1038/ijo.2010.216.
13.
Samocha-Bonet D, Chisholm DJ, Tonks K, Campbell LV, Greenfield
JR. Insulin-sensitive obesity in humans – a ‘favorable fat’ phenotype? Trends
Endocrinol Metab. 2012; 23(3): 116-124. doi: 10.1016/j.tem.2011.12.005.
14.
Rodríguez A, Gómez-Ambrosi J, Catalán V, Rotellar F, Valentí V,
Silva C, et al. The ghrelin O-acyltransferase–ghrelin system reduces
TNF-αinduced apoptosis and autophagy in human visceral adipocytes.
Diabetologia. 2012; 55(11): 3038-3050. doi: 10.1007/s00125-012-2671-5.
15.
Moreno-Castellanos N, Rodríguez A, RabanalRuiz Y, Fernández-Vega
A, López-Miranda J, Vázquez-Martínez R, et al. The cytoskeletal protein septin
11 is associated with human obesity and is involved in adipocyte lipid storage
and metabolism. Diabetologia. 2017; 60(2): 324-335. doi: 10.1007/
s00125-016-4155-5.
16.
Ye F, Zhang H, Yang Y-X, Hu H-D, Sze SK, Meng W, et al.
Comparative proteome analysis of 3T3-L1 adipocyte differentiation using
iTRAQ-coupled 2D LC-MS/MS. J Cell Biochem. 2011; 112(10): 30023014. doi:
10.1002/jcb.23223.
17.
Gómez-Serrano M, Camafeita E, López A, Rubio M, Bretón I, et al.
Differential proteomic and oxidative profiles unveil dysfunctional protein
import to adipocyte mitochondria in obesity-associated aging and diabetes.
Redox Biol. 2017; 11: 415-428. doi: 10.1016/j.redox.2016.12.013.
18.
Ojima K, Oe M, Nakajima I, Muroya S, Nishimura, T. Dynamics of
protein secretion during adipocyte differentiation. FEBS Open Bio. 2016; 6:
816-826.
doi: 10.1002/2211-5463.12091.
19.
Lee H-K, Lee B-H, Park S-A, Kim C-W. The proteomic analysis of an
adipocyte differentiated from human mesenchymal stem cells using
two-dimensional gel electrophoresis. Proteomics. 2006; 6(4): 1223-1229. doi:
10.1002/ pmic.200500385.
20.
Jeong JA, Ko K-M, Park HS, Lee J, Jang C, Jeon C-J, et al.
Membrane proteomic analysis of human mesenchymal stromal cells during
adipogenesis. Proteomics. 2007; 7(22): 4181-4191. doi: 10.1002/ pmic.200700502.
21.
Renes J, Mariman E. Application of proteomics technology in
adipocyte biology. Mol Biosyst. 2013; 9(6): 1076. doi: 10.1039/c3mb25596d.
22.
Lee M-J, Wu Y, Fried SK. Adipose tissue heterogeneity:
Implication of depot differences in adipose tissue for obesity complications.
Mol Aspects Med. 2013; 34(1): 1-11. doi: 10.1016/j. mam.2012.10.001.
23.
Peinado JR, Jimenez-Gomez Y, Pulido MR, Ortega-Bellido M,
Diaz-Lopez C, Padillo FJ, et al. The stromal-vascular fraction of adipose
tissue contributes to major differences between subcutaneous and visceral fat
depots. Proteomics.
2010; 10(18): 3356-3366. doi: 10.1002/
pmic.201000350.
24.
Moreno-Castellanos N, Guzmán-Ruiz R, Cano
DA, Madrazo-Atutxa A, Peinado JR, PereiraCunill JL, et al.
The effects of bariatric surgeryinduced weight loss on adipose tissue in
morbidly obese women depends on the initial metabolic status. Obes Surg. 2016;
26(8): 1757-1767. doi: 10.1007/s11695-015-1995-x.
25.
Kanzaki M, Pessin JE. Insulin-stimulated GLUT4 Translocation in
Adipocytes Is Dependent upon Cortical Actin Remodeling. J Biol Chem.
2001; 276(45): 42436-42444. doi: 10.1074/jbc. M108297200.
26.
Flynn JM, Melov S. SOD2 in mitochondrial dysfunction and
neurodegeneration. Free Radic Biol Med. 2013; 62: 4-12. doi: 10.1016/j.
freeradbiomed.2013.05.027.
27.
Furukawa S, Fujita T, Shimabukuro M, Iwaki M, Yamada Y, Nakajima
Y, et al. Increased oxidative stress in obesity and its impact on metabolic
syndrome. J Clin Invest. 2004; 114(12): 1752-1761. doi: 10.1172/JCI21625.
28.
Barbarroja N, López-Pedrera R, Mayas MD, GarcíaFuentes E,
Garrido-Sánchez L, Macías-González M, et al. The obese healthy paradox: is
inflammation the answer? Biochem J. 2010; 430(1): 141-149. doi:
10.1042/BJ20100285.
29.
Wellen KE, Hotamisligil GS. Inflammation, stress, and diabetes. J
Clin Invest. 2005; 115(5): 11111119. doi: 10.1172/JCI25102.
ile of preadipocytes with different
metabolic status